Lors du développement de prototypes de dispositifs médicaux , avez-vous déjà été confronté à ces dilemmes :
Vous avez passé trois mois à développer un prototype d'instrument chirurgical minimalement invasif qui n'a pas pu être utilisé lors de tests sur les animaux car les matériaux n'étaient pas conformes à la norme de biocompatibilité ISO 10993, ou vous avez rencontré des problèmes d'assemblage lors de la vérification fonctionnelle qui ont nécessité la mise au rebut et un nouveau départ ?

En tant qu'équipe de prototypage rapide spécialisée dans le développement de prototypes de dispositifs médicaux, je sais pertinemment à quel point ces problèmes peuvent bloquer un projet pendant des mois. C'est pourquoi j'ai rédigé ce guide pour vous aider à éviter les pièges de la conformité, à choisir les processus adéquats et à maîtriser les coûts, afin que le développement de vos prototypes de dispositifs médicaux se déroule beaucoup plus facilement.
Résumé des réponses principales
| Dimensions de comparaison | Prototypes imprimés en 3D | Prototypes d'usinage CNC |
| Avantages principaux | Itération rapide, liberté géométrique inégalée. | Propriétés des matériaux réalistes, ultra-haute précision et finition de surface. |
| Phases d'application appropriées | Preuve de concept, ajustement morphologique préliminaire. | Tests fonctionnels, essais précliniques et soumission de la demande d'enregistrement. |
| Matériaux applicables | Résine photosensible, plastiques techniques. | Acier inoxydable médical, alliage de titane, PEEK. |
| Précision et état de surface | Superposition potentielle, nécessitant un post-traitement. | Finition de surface miroir, tolérances précises. |
| rapport coût-efficacité | Faible coût unitaire pour les structures complexes. | Rapport coût-efficacité élevé pour les petits lots et les pièces exigeantes. |
| Soutien à la conformité | ★★★☆☆ - Dépend de la certification du matériau. | ★★★★★ - Traçabilité simplifiée des matériaux et des processus. |
Pourquoi faire confiance à ce guide ? L’expertise de JS Precision en matière de conformité des prototypes de dispositifs médicaux
Avant de répondre à la question « Pourquoi faire confiance à ce guide ? », j’aimerais partager l’expérience concrète de JS Precision. Depuis 15 ans, nous nous spécialisons dans le prototypage rapide de dispositifs médicaux et accompagnons plus de 500 clients du secteur médical.
Des petits prototypes de moniteurs de glycémie pour start-ups aux grands systèmes de pose de stents cardiaques pour multinationales, nous avons même réalisé l'usinage interne complexe en alliage de titane pour des instruments chirurgicaux mini-invasifs, permettant ainsi à nos clients de passer de la conception à la validation en seulement 45 jours.
Notre équipe maîtrise parfaitement les directives de la FDA relatives aux prototypes , et notre taux d'approbation des prototypes de dispositifs médicaux dépasse largement la moyenne du secteur. Par exemple, l'année dernière, un client spécialisé dans le développement de dispositifs neurointerventionnels a rencontré des difficultés lors de sa demande d'autorisation, car son prototype ne répondait pas aux exigences de traçabilité de la FDA.
Après avoir pris le relais, nous avons retravaillé le prototype et avons réussi à respecter les normes de précision, tout en complétant toute la documentation, y compris les lots de matériaux et les paramètres de traitement, afin de faciliter la réussite de l'examen.
Il ne s'agit pas d'un recueil de théories, mais plutôt de la synthèse de 15 années d'expérience pratique condensée dans ce guide.Chaque suggestion vous aidera à résoudre des problèmes pratiques, comme la maîtrise des coûts lors de la phase de prototypage ou le choix du procédé adapté aux normes ISO 13485 relatives aux dispositifs médicaux . Vous pouvez lui faire confiance en toute sérénité.
Vous souhaitez minimiser les risques de non-conformité lors du développement de prototypes de dispositifs médicaux ? Contactez JS Precision : forts de 15 ans d’expérience en matière de conformité, nous vous proposons une évaluation gratuite sur site de la traçabilité et de l’exhaustivité de la documentation de votre prototype. Vous gagnerez ainsi du temps lors des étapes ultérieures concernant la certification des matériaux et les enregistrements de traitement, et vous accélérerez le processus de demande d’autorisation auprès de la FDA.
Qu’est-ce qui définit véritablement un prototype de dispositif médical réussi ?
Le chapitre précédent a démontré la crédibilité des principes directeurs. Ce chapitre explique qu'un prototype de dispositif médical réussi repose sur l'intégration de la fonction, de la forme et de la conformité. Les points essentiels sont les suivants :
La multidimensionnalité des normes pour un prototype réussi
- Fonctionnalités : Le prototype simule les performances du produit final. Par exemple : la force d’ouverture et de fermeture des instruments chirurgicaux sera identique à celle de la version produite en série.
- Représentativité : Utilise des matériaux cibles ou similaires (en évitant la substitution de matériaux clés comme les alliages de titane par du plastique).
- Testabilité : S'adapte aux processus de validation, tels que les prototypes implantables dotés d'interfaces de capteurs réservées.
- Prévision de la conformité : Documentation préalable pour la certification des matériaux , réduisant ainsi le délai d’obtention des autorisations réglementaires.
Objectifs du prototype à différentes étapes
- Preuve de concept : utiliser l’impression 3D pour créer des maquettes grossières, prouvant ainsi la faisabilité du concept.
- Phase de prototypage fonctionnel : garantir la précision grâce à l’usinage CNC et à des tests de performance complets.
- Phase d'essai clinique : se conformer aux normes ISO 13485 relatives aux dispositifs médicaux, comblant ainsi le fossé avec la production de masse.
JS Precision définit les objectifs du prototype en fonction des étapes du projet du client. Par exemple, pour un prototype de stylo à insuline, nous itérons l'apparence par impression 3D et garantissons la précision par usinage CNC, étape par étape.
Impression 3D ou usinage CNC : quelle voie choisir pour le développement de votre prototype de dispositif médical ?
Une fois les critères de réussite d'un prototype définis, il convient de sélectionner la technologie d'usinage appropriée. Il n'existe pas de solution « idéale » entre l'impression 3D et l'usinage CNC, mais seulement la solution « la plus adaptée ». Voici les principaux éléments de comparaison :
| Dimensions de comparaison | Impression 3D | Usinage CNC |
| Vitesse | Rapide : Structures simples 1 à 3 jours. | Moyen : Structures complexes 3-7 jours. |
| Coût | Faible (petit lot de pièces simples). | Moyen-élevé (pièces complexes de haute précision). |
| Matériels | Résine, poudre métallique. | Tous les métaux, plastiques médicaux, PEEK, etc. |
| Précision | ±0,1 mm (convient pour une preuve de concept). | ± 0,005 mm (convient aux applications fonctionnelles/cliniques). |
| Évolutivité | Itération par petits lots (5 à 10 pièces). | Connexion à la production de masse (pas besoin de modifier le processus). |
Logique de sélection technologique :
- Phase de validation de concept : se concentrer sur l’itération rapide de l’apparence/structure grâce à l’impression 3D.
- Phase de test fonctionnel/clinique : privilégier l’usinage CNC pour la précision de ses performances mécaniques.
- Exigences complexes : Utilisation hybride requise, entre l'impression 3D pour la conception des écrans et la commande numérique pour le prototypage fonctionnel.
JS Precision propose des stratégies de fabrication hybrides, notamment pour le développement de prototypes de dispositifs médicaux. Vous hésitez sur la technologie la plus adaptée ? Envoyez-nous vos plans de pièces et nous vous fournirons gratuitement des analyses comparatives de procédés afin de réduire vos coûts de développement.

Figure 1 : Impression 3D de dispositifs médicaux. L’impression 3D convient à une large gamme de prototypes de dispositifs médicaux, des modèles conceptuels initiaux aux prototypes fonctionnels destinés aux tests.
Pourquoi l'approche DFM doit-elle être intégrée dès le début du développement de prototypes de dispositifs médicaux ?
Immédiatement après le choix de la technologie de fabrication, une étape cruciale à ne pas négliger est la conception pour la fabrication (DFM). Nombreux sont ceux qui attendent la production en série pour prendre en compte la DFM, pourtant, l'intégrer dès la phase de prototypage peut vous faire gagner un temps précieux et réduire considérablement vos coûts.
Raison principale de l'intégration de la conception pour la fabrication (DFM) au stade du prototype
Si la conception du prototype ne convient pas à la fabrication, des modifications importantes peuvent devoir être apportées lors de la production en série.
Par exemple, un client a fabriqué un prototype de set de perfusion composé de trois pièces. Lors du lancement de la production en série, il a constaté une faible efficacité d'assemblage et des coûts élevés ; il a donc opté pour une conception monobloc. Ce changement a rallongé le délai du projet de deux mois et engendré un surcoût de 20 000 $. L'intégration précoce des principes de conception pour la fabrication (DFM) permet d'éviter ce type de problèmes.
Trois pratiques fondamentales de la conception pour la fabrication (DFM) en phase de prototypage
- Planification de la transition des matériaux : Les différences mécaniques entre les matériaux du prototype et ceux de la production en série doivent être testées afin d’éviter les défaillances de performance , comme la transition de l’ABS au PEEK.
- Conception d'assemblage simplifiée : Vérifier les enclenchements et les vis de fixation dans le prototype afin de réduire le nombre de pièces, par exemple, les pinces chirurgicales de 4 à 2 pièces.
- Conception à tolérance raisonnable : définir une tolérance de ±0,1 mm pour les surfaces non critiques afin d’éviter une précision excessive et de contrôler le coût du prototypage des dispositifs médicaux.
Quels sont les principaux facteurs qui influencent le coût du prototypage des dispositifs médicaux ?
Une bonne analyse de fabricabilité (DFM) permet de maîtriser les coûts, mais il est également essentiel de comprendre les facteurs qui influent directement sur le coût du prototypage de dispositifs médicaux. Seule une compréhension approfondie de la structure des coûts permet d'établir un budget raisonnable et d'éviter les dépassements budgétaires. Les principaux facteurs déterminants sont les suivants :
Coût et disponibilité des matériaux :
Certains matériaux spéciaux de qualité médicale sont très coûteux, comme le PEEK et l'alliage de titane. (Un kilogramme de PEEK coûte plusieurs centaines de dollars américains.) Certains de ces matériaux doivent être importés, et les longs délais de livraison augmentent les coûts d'attente.
Complexité géométrique :
Par exemple, si le prototype contient des cavités internes complexes (canaux de 2 mm de diamètre) ou des détails minuscules (parois minces de 0,5 mm), le traitement prendra beaucoup plus de temps et coûtera en conséquence : alors que le traitement d'un simple prototype de plaque plate coûterait 200 $, le traitement d'un prototype d'instrument chirurgical avec des cavités internes complexes peut dépasser 1000 $.
Exigences en matière de précision et de finition de surface :
L'augmentation du niveau de précision entraîne une augmentation exponentielle des coûts. Par exemple, passer d'une précision de ±0,1 mm à ±0,01 mm double le coût de traitement. De même, un état de surface de haute qualité implique un polissage supplémentaire, facturé plusieurs centaines de dollars américains par mètre carré.
Exigences de post-traitement et de nettoyage :
Les prototypes médicaux nécessitent un nettoyage aseptique (50 à 100 $/intervention) et un ébavurage.L'ébavurage manuel des pièces complexes coûte 200 $. Tout traitement supérieur à 1000 $ US, incluant l'anodisation de surface, sera facturé en supplément .
Documentation de conformité :
Fournir les certifications de matériaux, les dossiers de traitement et autres documents nécessite du temps d'ingénieur ; un document complet de conformité à la norme ISO 13485 coûte entre 1000 et 2000 USD.

Figure 2 : Certaines applications de dispositifs médicaux nécessitent des finitions de surface (en particulier des finitions polies et miroir) à des fins d'assainissement et de propreté.
Quelles sont les exigences particulières en matière de matériaux pour le prototypage de dispositifs médicaux ?
Une fois les facteurs de coût compris, concentrons-nous sur le facteur matériel. Les exigences relatives aux matériaux pour le prototypage de dispositifs médicaux sont bien plus élevées que pour les produits courants. Il ne suffit pas d'examiner les propriétés mécaniques ; il faut également prendre en compte quatre exigences spécifiques :
- Biocompatibilité : Conformément aux normes ISO 10993 afin d'éviter les allergies ou les inflammations dues à l'implantation du prototype (l'utilisation d'un alliage de titane est due au taux de rejet nul).
- Stérilisation : Résistant aux rayons gamma, à l'oxyde d'éthylène et à la stérilisation à la vapeur (les métaux ont une meilleure compatibilité que les résines).
- Propriétés mécaniques : résistance à la fatigue à long terme privilégiée. Le PEEK, par exemple, est utilisé dans les dispositifs réutilisables.
- Stabilité chimique : Le matériau ne réagit pas avec les médicaments ni avec le sang ; par exemple, les matériaux d'un set de perfusion ne se dissolvent pas dans les médicaments.
JS Precision assure la gestion complète des stocks et des certifications pour les matériaux de qualité médicale. Notre entrepôt est régulièrement approvisionné en divers matériaux, notamment des alliages de titane, du PEEK et de l'ABS de qualité médicale. Chaque lot est entièrement documenté et certifié afin de garantir que les prototypes répondent aux exigences réglementaires dès leur fabrication.
Vous ne savez pas quel matériau convient au prototypage de dispositifs médicaux ? Contactez JS Precision : nous proposons une gamme de matériaux médicaux certifiés ISO 10993 et des certificats de lot pour garantir la conformité dès le départ.

Figure 3 : Vis biocompatibles. La biocompatibilité est une condition nécessaire pour tout dispositif entrant en contact avec le corps humain.
Facteurs critiques lors du choix d'une entreprise de prototypage de dispositifs médicaux
Après avoir sélectionné les matériaux et les procédés, les 7 points suivants doivent être pris en compte lors du choix d'entreprises de prototypage de dispositifs médicaux :
- Certification ISO 13485 : Norme de base du secteur médical, obtenue par JS Precision et soumise à des audits réguliers.
- Connaissance de la réglementation de la FDA : Comprendre ce qui doit figurer dans la documentation du prototype afin d’éviter d’avoir à fournir des documents supplémentaires ultérieurement.
- Niveau des services d'ingénierie de prototypes de dispositifs médicaux : Conseils en matière de fabrication et capacité d'optimisation de la conception.
- Diversité des équipements : des machines CNC 5 axes et des imprimantes 3D métal sont disponibles pour le traitement de structures complexes.
- Bibliothèque de matériaux et certifications : Inventaire des matériaux médicaux couramment utilisés, fournissant des rapports de biocompatibilité et autres documents.
- Processus d'inspection de la qualité : Tests de précision par machine à mesurer tridimensionnelle et tests de stérilité pour garantir la qualité des prototypes.
- Protection de la propriété intellectuelle : Des accords de confidentialité stricts sont en place ; JS n’a connaissance d’aucun cas de fuite de propriété intellectuelle.
Vous recherchez actuellement une entreprise de prototypage de dispositifs médicaux ? Demandez une copie des documents de certification ISO 13485 et du manuel des procédures d'inspection qualité de JS Precision. Nous vous présenterons clairement nos capacités de conformité et notre expertise technique, afin de vous aider à faire le bon choix.
Votre prototype doit-il être conforme à la norme ISO 13485 relative aux dispositifs médicaux ?
De nombreux clients me demandent : « La phase de prototypage doit-elle être conforme à la norme ISO 13485 relative aux dispositifs médicaux ? » Ma réponse est : absolument. Car l’ISO 13485 n’est pas qu’une simple certification , mais influence directement chaque étape de la production d’un prototype. Les exigences essentielles sont les suivantes :
- Traçabilité : Les lots de matériaux et les paramètres de traitement, tels que les fournisseurs d'alliages de titane et les vitesses des machines CNC, sont enregistrés à des fins d'archivage.
- Validation du processus : fixation des paramètres d’impression 3D tels que la température et l’épaisseur des couches afin d’ éviter d’éventuelles fluctuations de qualité.
- Contrôle documentaire : Consignez toutes les modifications de conception et les résultats des tests ; aucune modification n’est apportée sans documentation.
Chez JS Precision, dès que vous passez votre commande, votre prototype est Nous opérons déjà dans un système contrôlé et conforme à la norme ISO 13485. Par exemple, si vous réalisez un prototype d'instrument chirurgical, nous pourrons vous fournir une documentation complète, incluant les certifications des matériaux, les dossiers de fabrication et les rapports d'inspection.
Ces documents vous fourniront une base solide pour vos demandes auprès de la FDA, car ils peuvent être utilisés directement.
De nombreux clients ayant réalisé eux-mêmes leurs prototypes n'ont pas consigné ces informations et se sont retrouvés avec trois mois de retard lorsque la FDA a exigé ces documents lors de la procédure de demande d'autorisation. En revanche, le prototype que nous avons conçu, accompagné d'une documentation complète, a été approuvé du premier coup.
Gestion proactive des risques dans les services d'ingénierie de prototypes de dispositifs médicaux
Une fois la norme ISO 13485 relative aux dispositifs médicaux respectée, la gestion des risques devient efficace. Les risques sont omniprésents dans les services d'ingénierie de prototypes de dispositifs médicaux ; ils peuvent notamment être liés à des défauts de conception, à la contamination lors de la fabrication ou à une mauvaise utilisation. Seule l'identification et la maîtrise des risques en amont permettent d'éviter les défaillances des prototypes.
Processus de gestion des risques basé sur la norme ISO 14971
Nous suivons le processus « Identification des risques → Évaluation des niveaux de risque → Élaboration de mesures de contrôle », en nous concentrant sur les problèmes à haut risque.
Par exemple, lors de la phase de conception, nous listons les risques susceptibles d'apparaître, tels que « une résistance insuffisante du prototype » et « un écart dimensionnel excessif », nous évaluons la probabilité de leur occurrence et leur impact, et nous nous concentrons en priorité sur la résolution des problèmes à forte probabilité et à fort impact .
Trois étapes pratiques pour la maîtrise des risques au stade du prototype
- AMDEC de conception : analyser les défauts possibles, tels que l’optimisation de la tolérance de diamètre des tubulures dans les prototypes de dispositifs de perfusion.
- AMDEC de fabrication : Nettoyer régulièrement les machines-outils pour éviter toute contamination. Contrôler les dimensions toutes les 2 heures.
- AMDEC utilisateur : simuler une mauvaise utilisation (par exemple, une mauvaise manipulation de forceps chirurgicaux) et optimiser la conception de la poignée pour améliorer la sécurité.
Étude de cas : JS Precision aide les instruments chirurgicaux mini-invasifs à réaliser des économies de temps de 75 %
Maintenant que de nombreuses théories et méthodes ont été abordées, je vais passer à l'exemple concret d'un cas réel afin de démontrer comment JS Precision aide ses clients à résoudre des problèmes pratiques.
Besoins du client
Le client est une start-up spécialisée dans les instruments chirurgicaux mini-invasifs. Il devait développer un prototype d'instrument portatif en alliage de titane. Cet instrument devait répondre à deux exigences essentielles :
- Léger : ≤50 g, léger pour permettre aux chirurgiens d'opérer facilement et en continu.
- Haute résistance : résistance à la traction ≥ 800 MPa pour éviter la rupture lors des interventions chirurgicales.
Un canal interne de seulement 2 mm de diamètre exige une surface lisse et sans bavure ; toute imperfection compromettrait le bon fonctionnement de l’instrument. Le client développait ce prototype en vue d’essais sur des animaux et d’une demande d’autorisation de mise sur le marché (510(k)) auprès de la FDA.
Auparavant, le client avait contacté d'autres fournisseurs, mais ceux-ci n'avaient pas été en mesure de fabriquer les canaux internes complexes. Cela a entraîné un retard d'un mois et un gaspillage de 5 000 $. Le client s'est alors tourné vers JS Precision, auquel nous avons proposé une solution en trois étapes.
La solution triple de JS Precision
1. Prototypage initial :
Création rapide d'un modèle représentatif d'un concept de cavité interne complexe à l'aide de l'impression 3D métal (poudre d'alliage de titane), qui a été réalisée en 3 jours , lors de la vérification de la forme et de l'assemblage, il a été constaté que la paroi mince de 1 mm était susceptible de générer une déformation et, par conséquent, l'épaisseur a été modifiée à 1,2 mm.
2. Créer des prototypes fonctionnels :
Passage à l'utilisation de l'usinage CNC 5 axes, avec fraisage unique du corps principal à partir d'une barre d'alliage de titane TC4, la technologie de fraisage à grande vitesse garantit une rugosité de surface Ra dans les canaux internes ≤0,8 μm, avec DFM appliqué pour optimiser la structure de la poignée, tout en maintenant le poids sous les 48 g.
3. Assistance en matière de conformité :
Compiler des certifications complètes de matériaux selon les normes ASTM F136 et des dossiers d'usinage, y compris les paramètres d'usinage et les rapports d'inspection dimensionnelle pour chaque étape, conformément à la norme ISO 13485, afin de soutenir directement une demande auprès de la FDA.
Résultats finaux
Le cycle de développement initial du prototype, prévu pour six mois, a été ramené à un mois et demi, soit un gain de temps de 75 %. Le premier prototype fonctionnel a passé avec succès les tests sur les animaux, sans coûts d'itération supplémentaires, et a permis de faire progresser directement le processus de demande d'autorisation auprès de la FDA.
Vous souhaitez optimiser le temps et réduire les coûts de développement de vos prototypes de dispositifs médicaux ? Contactez JS Precision pour découvrir comment nous combinons l’impression 3D et la technologie CNC afin de concevoir une solution de développement performante et sur mesure, vous permettant de maîtriser les coûts de prototypage de vos dispositifs médicaux.
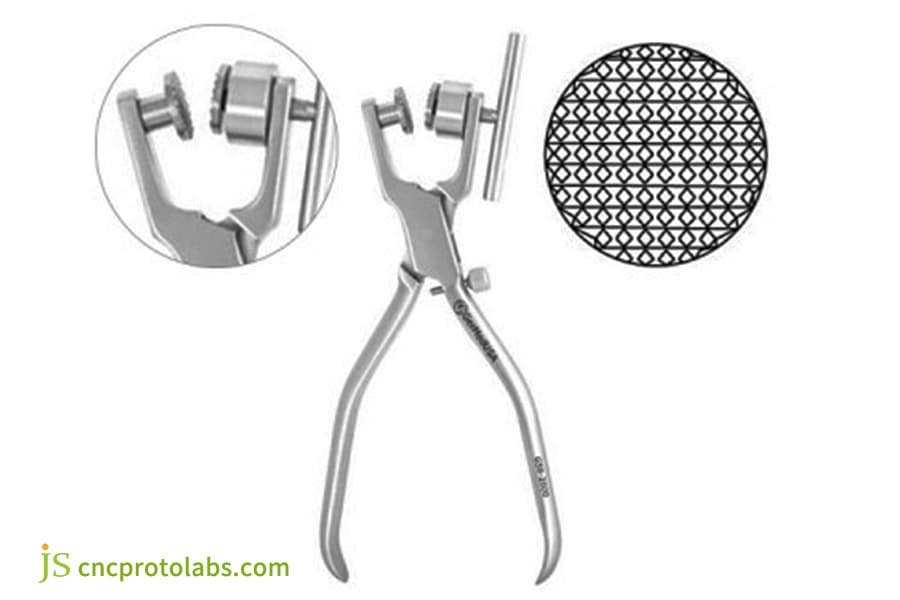
Figure 4 : Broyeur à os manuel en alliage de titane
Prêt à démarrer votre projet ? Comment collaborer avec JS Precision ?
Maintenant que vous maîtrisez les principaux aspects du développement de prototypes, si vous êtes prêt à lancer un projet, votre partenariat avec JS Precision se résume à quatre étapes simples et directes :
1. Consultation et analyse des besoins : Informez notre équipe des exigences fonctionnelles, des normes de conformité du prototype (directives de la FDA) et de la phase du projet. Notre équipe pourra ainsi définir les exigences essentielles.
2. Examen de la conception et du processus : Nos ingénieurs vous fourniront des recommandations DFM pour votre conception, détermineront la technologie de traitement appropriée (impression 3D ou usinage CNC, ou procédés hybrides) et vous proposeront une conception préliminaire.
3. Fabrication et contrôle qualité : Le prototype doit être fabriqué conformément à la norme ISO 13485. Des contrôles dimensionnels complets (machine à mesurer tridimensionnelle) et des tests de performance (tels que des tests de stérilité) doivent être effectués pour garantir la qualité du prototype.
4. Livraison et assistance : Nous livrerons le prototype et la documentation complète de conformité (certifications des matériaux, dossiers de traitement, rapports d'inspection) et fournirons une assistance ultérieure telle que l'optimisation de la conception et le traitement itératif.
Nous vous recommandons de faire appel à l'équipe d'ingénierie de JS Precision dès que possible afin d'obtenir des recommandations en matière de fabrication (DFM) et des solutions d'optimisation des coûts au plus tôt, et ainsi éviter des modifications de conception ultérieures. Nos services d'ingénierie de prototypes de dispositifs médicaux, offrant une solution complète, vous accompagneront tout au long du processus, du prototype à la production en série.
FAQ
Q1 : Les prototypes de dispositifs médicaux et les produits finaux doivent-ils utiliser les mêmes matériaux ?
Pas nécessairement, mais JS Precision suggère l'utilisation de matériaux aux performances similaires ou déjà certifiés , afin de garantir des résultats de tests valides et une transition aisée du prototype à la production de masse sans les problèmes liés au remplacement des matériaux.
Q2 : Dois-je tenir compte des exigences de la FDA dès le stade du prototype ?
Absolument. L'intégration précoce des directives de la FDA concernant les prototypes, telles que les normes d'ergonomie et d'essais, peut éviter des modifications majeures de la conception ultérieurement, ce qui constitue une étape clé pour accélérer le lancement du produit.
Q3 : JS Precision propose-t-il autre chose que des prototypes ?
Oui, notre gamme complète de services s'étend du développement de prototypes à la production pilote en petites séries, en passant par l'optimisation DFM, la documentation de conformité et l'intégration des processus de production de masse qui garantissent une transition fluide du concept au marché.
Q4 : Les prototypes imprimés en 3D peuvent-ils être utilisés pour des applications d'enregistrement clinique ?
Oui, mais trois conditions doivent être remplies : certification de biocompatibilité des matériaux, validation du procédé et documentation complète. La documentation des prototypes usinés CNC de JS Precision présente généralement un avantage certain.
Q5 : Quel est le cycle de développement typique d'un prototype de dispositif médical ?
Ces délais varient de quelques semaines à plusieurs mois , selon la complexité du prototype, la technologie choisie et le nombre d'itérations. JS Precision utilise l'ingénierie simultanée et une chaîne d'approvisionnement performante pour minimiser les délais de développement.
Q6 : Quelles sont les principales considérations pour les prototypes de dispositifs implantables ?
Les trois critères essentiels sont la biocompatibilité, les propriétés mécaniques à long terme (notamment la résistance à la fatigue) et la stérilisabilité. JS Precision vous accompagne dans le choix des matériaux et des procédés les plus adaptés pour répondre à ces trois exigences.
Q7 : L'estimation des coûts comprend-elle tous les travaux de post-traitement et d'inspection ?
Chez JS Precision, la tarification est toujours transparente. Tous les coûts, tels que le nettoyage, l'ébavurage, le contrôle de la pièce et le traitement aseptique, sont clairement indiqués, sans aucun frais caché.
Q8 : Quel est le point clé le plus souvent négligé lors du choix du fournisseur pour le prototype du dispositif médical ?
Il s'agit du système qualité et des capacités de documentation du fournisseur. Bien qu'il soit important de fabriquer des pièces esthétiquement plaisantes, une documentation de conformité complète à l'appui de l'enregistrement est bien plus importante pour le traitement ultérieur de la demande.
Résumé
La réussite d'un prototype de dispositif médical n'est pas une question de chance ; il s'agit d'équilibrer fonctionnalité, conformité et coût, et de sélectionner les technologies, les matériaux et les partenaires appropriés.
Avec plus de 15 ans d'expérience pratique, JS Precision sait que la planification préalable de la conformité, la mise en œuvre d'une conception pour la fabrication (DFM) appropriée et le contrôle des risques peuvent épargner au développement d'un prototype la plupart des pièges.
Passez à l'action et mettez vos idées sur la voie rapide du succès dès maintenant !
Envoyez-nous simplement vos fichiers CAO ainsi que vos exigences initiales, et vous recevrez une solution professionnelle sous 24 heures comprenant également des suggestions préliminaires de conception pour la fabrication (DFM), une feuille de route du processus et un devis transparent.
Clause de non-responsabilité
Le contenu de cette page est fourni à titre informatif uniquement. JS Precision Services n'offre aucune garantie, expresse ou implicite, quant à l'exactitude, l'exhaustivité ou la validité des informations. Il ne faut pas en déduire qu'un fournisseur ou fabricant tiers fournira, par l'intermédiaire du réseau JS Precision, les paramètres de performance, les tolérances géométriques, les caractéristiques de conception spécifiques, la qualité et le type des matériaux ou la qualité de la fabrication. Il est de la responsabilité de l'acheteur de demander un devis pour les pièces et de préciser ses exigences concernant ces sections. Veuillez nous contacter pour plus d'informations .
Équipe de précision JS
JS Precision est une entreprise leader du secteur , spécialisée dans les solutions de fabrication sur mesure. Forte de plus de 20 ans d'expérience et de plus de 5 000 clients, elle se concentre sur l'usinage CNC de haute précision, la fabrication de tôlerie et l'impression 3D .com/injection-molding">Moulage par injection, emboutissage de métaux et autres services de fabrication clés en main.
Notre usine est équipée de plus de 100 centres d'usinage 5 axes de pointe, certifiés ISO 9001:2015. Nous fournissons des solutions de fabrication rapides, efficaces et de haute qualité à des clients dans plus de 150 pays à travers le monde. Qu'il s'agisse de petites séries ou de personnalisations à grande échelle, nous répondons à vos besoins avec une livraison express sous 24 heures. Choisir JS Precision, c'est opter pour l'efficacité, la qualité et le professionnalisme.
Pour en savoir plus, consultez notre site web : www.cncprotolabs.com





